 Je réponds aujourd'hui à l'excellente question d'Amina qui va me permettre d'expliquer un tas de choses et d'assumer au grand jour ma passion pour les GIFs animés !
Je réponds aujourd'hui à l'excellente question d'Amina qui va me permettre d'expliquer un tas de choses et d'assumer au grand jour ma passion pour les GIFs animés !Les molécules sont des assemblages d'atomes, attachés les uns aux autres par des forces de liaison. Les molécules les plus simples sont composées de deux atomes, comme le dioxygène que tu respires. D'autres molécules plus complexes sont composées de centaines ou de milliers d'atomes. Quant aux molécules d'ADN contenues dans chacune des cellules de ton corps, elles comportent des milliards d'atomes ! Mais ce n'est pas aussi compliqué qu'il n'y parait : assembler des atomes ressemble un peu à un jeu de montage microscopique, avec certaines règles à respecter. Voyons comment tout cela marche, en commençant par considérer les "briques" élémentaires de ce jeu : les atomes.
Les atomes
Les atomes sont comme de minuscules billes qui composent toute la matière ordinaire ; ton corps, l'air que tu respires, tes doigts de pied, les chaussettes que tu portes, les microbes, le chat du voisin, Barack Obama, la Terre et tout ce qu'il y a chez toi : tout cela est composé d'atomes. Les atomes sont si petits que tu pourrais en ranger un milliard en file indienne sur une règle de 30 centimètres. Ils sont si légers, qu'il faudrait un milliard de files indiennes d'un milliard d'atomes pour faire un milliardième de kilogrammes (tu as suivi ?) ! Mais les atomes sont aussi incroyablement solides : il est presque impossible de les casser. Les atomes n'ont pas tous la même taille, il en existe environ 118 différents ! J'écris "environ" car on en découvre/fabrique régulièrement des nouveaux. C'est peu si l'on considère l’extraordinaire variété des formes du monde dans lequel nous vivons !Les atomes sont eux-mêmes composés de protons (des particules de charge électrique positive), de neutrons (des particules de charge électrique neutre) et d'électrons (des particules de charge électrique négative). Les protons et les neutrons sont concentrés au centre de l'atome et forment le noyau. Les électrons, qui sont bien plus petits, forment une sorte de nuage diffus qui entoure le noyau. Comme les atomes sont électriquement neutres, ils ont le même nombre de protons et d’électrons. L'atome le plus simple est l'atome d'hydrogène, il possède un seul proton, et donc un seul électron. L'oxygène est un atome plus grand : il possède 8 protons (et donc 8 électrons). L'uranium quant à lui, possède 92 protons, ce qui en fait un élément presque aussi lourd que Patrick Sébastien.
Les électrons sont classiquement représentés comme gravitants autour du noyau. Ils "tournent" sur des couches concentriques, très loin du noyau (pour des questions de facilité, les schémas ci-dessous ne sont pas du tout à l'échelle).
 |
| De gauche à droite : représentation usuelle de la structure électronique des atomes d'Hydrogène, d'Oxygène et d'Uranium. |
 |
| Schéma des trois premières couches électroniques |
La formation des liaisons atomiques
Si je te bassine avec ces histoires de couche électronique, c'est que ce sont les électrons situés sur la couche la plus éloignée du noyau (la couche externe) qui vont créer des liaisons atomiques. Pour s'attacher l'un à l'autre, des atomes vont partager les électrons de leurs couches externes respectives.Il existe quelques règles simples pour cela. Lorsqu'une liaison se forme, chaque atome met en commun le même nombre d'électrons. C'est comme si les atomes se donnaient la main : chaque atome doit tendre la main vers l'autre, en donnant le même nombre d'électrons. Des atomes dont la couche externe est incomplète vont chercher à la compléter, car un atome dont la couche externe est pleine devient plus stable. En revanche, un atome qui a une couche externe occupée au maximum (on dit qu'elle est saturée) ne cherchera pas à former des liaisons. Le nombre d'électrons sur la dernière couche va donc présider à la formation ou non d'assemblages d'atomes. L'atome d'oxygène par exemple, qu'on a vu un peu plus haut, possède 6 électrons sur sa couche externe (la couche L) alors qu'il pourrait en avoir 8. Il va donc essayer de trouver deux électrons quelque part. C'est pourquoi l'oxygène est un élément très réactif qui n'est presque jamais seul. L'atome d'hydrogène, lui, n'a qu'un seul électron sur sa couche externe, alors qu'il voudrait en avoir deux. L'atome d'oxygène peut donc s'associer à deux atomes d'hydrogène, qui vont partager chacun un électron, et former ainsi une molécule d'eau :
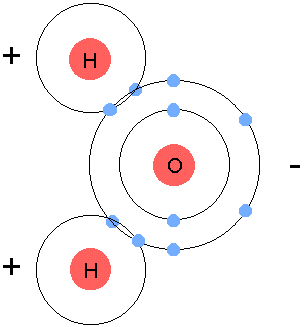 |
| Molécule d'eau. Crédits : Michael Gregory |
 |
| Molécule de dioxygène. Crédits : Michael Gregory |
 |
| Formation de la molécule de dioxygène |
Un
atome peut aussi s'associer à plusieurs atomes différents. Le carbone
par exemple, possède 4 électrons sur sa couche externe. Il peut former des
liaisons avec lui même, ou avec d'autres atomes. Il peut par exemple se lier avec 4 atomes d'hydrogène qui vont donner chacun un électron, pour former un gaz appelé méthane.
 |
| 4 atomes d'Hydrogène et un atome de Carbone. Crédits : Michael Gregory |
 |
| Molécule de méthane. Crédits : Michael Gregory |
Le carbone peut aussi former des
molécules très longues, avec une ou plusieurs chaines d'atomes. Voici par exemple l'octane qui comporte une seule chaine de 8 atomes de carbone et 18 atomes d'hydrogène.
Comme il est un peu fastidieux de tout représenter, les chimistes utilisent des représentations simplifiées pour les molécules. En voici quelques-unes pour l'octane :
Les molécules
Il existe beaucoup d'autres combinaisons possibles, parfois très compliquées, avec plein d'atomes différents ! Une molécule peut réagir avec une autre pour donner une nouvelle molécule plus grande. A l'inverse, une molécule peut être cassée en plusieurs petites molécules. La forme et les groupes d'atomes spécifiques donnent aux molécules leurs propriétés. Le groupement O-H par exemple (un atome d'oxygène et un atome d'hydrogène) est caractéristique des molécules appelées "alcools". Il existe une branche de la chimie spécialement dédiée à l'étude de ces molécules carbonées : la chimie organique (j'essaierai d'en parler une autre fois). Elle a permis des progrès extraordinaires dans l'industrie et dans la recherche de médicaments. Elle a même conduit à la fabrication de molécules en forme de ballon de football !
 |
| Molécule de Buckminsterfullerene |
Le rôle des molécules
 |
| Structure d'un fragment d'ADN |
Des molécules synthétiques
L'Homme a aussi appris à fabriquer lui même des molécules. Parfois, il est en effet plus facile et moins cher de synthétiser une molécule plutôt que de l'extraire d'un produit naturel. C'est le cas de la vanilline par exemple, la molécule qui donne son goût à la vanille. L'Homme a aussi entièrement crée de nouvelles molécules. Les polymères par exemple, sont des molécules en chaînes extrêmement longues qui forment certains plastiques, des peintures ou des résines. D'autres molécules ont été créées pour rendre tes chaussures imperméables, les poêles anti-adhésives, pour parfumer les bonbons ou pour donner un goût bizarre au coca zéro. Certaines molécules synthétiques se sont avérées dangereuses pour l'Homme et la nature. On peut citer, entre autres, les pesticides, les engrais chimiques, les gaz à effet de serre ou plus récemment le bisphénol A. Cela ne veut pas dire que toutes les molécules synthétiques sont dangereuses, simplement qu'il faut faire attention. A l'inverse, certaines molécules naturelles sont toxiques ou dangereuses pour l'Homme. Le dichlore, l'ozone et le monoxyde de carbone par exemple, sont des gaz toxiques voire mortels. Si tu t'es déjà fait piquer par une guêpe, tu sais que la nature peut produire des molécules très désagréables ! Et c'est loin d'être la pire expérience de ce genre ! |
| Molécule d'Aspirine |
Voilà Amina, j'espère que j'ai à peu près réussi à t'expliquer ce qu'est une molécule. Si ce n'est pas le cas, n'hésite pas à me le faire savoir. Tu peux aussi te consoler avec ces GIFs que j'ai jugés trop distrayants pour être casés ailleurs qu'à la fin de l'article.
À découvrir sur le C@fé des Sciences :
Molécules d'été et divers ou Comment palper les molécules de la vie
Lait humain et molécule anti-cancéreuse
L’auto-catalyse : le concept-clé de l’apparition de la vie
















Très bon article! Étrangement l'explication de la structure atomique semble mieux passer avec les GiFs et les références à TTBT... :)
RépondreSupprimerMerci :) Les gifs rendraient n'importe quoi intéressant :)
RépondreSupprimerChouette article effectivement ! je me dis que le début est kidisciençable, non ? Moi quand j'ai appris les liaisons covalentes en 2e, j'étais toute émerveillée de pouvoir expliquer la formation de la plupart des molécules qui m'entouraient...
RépondreSupprimerBon récemment j'ai découvert çà...Tu connais ce concept ?
http://www.eoht.info/page/Human+molecule
A +...
c'etait trop bien ca n,ous a beaucoup aider
RépondreSupprimer